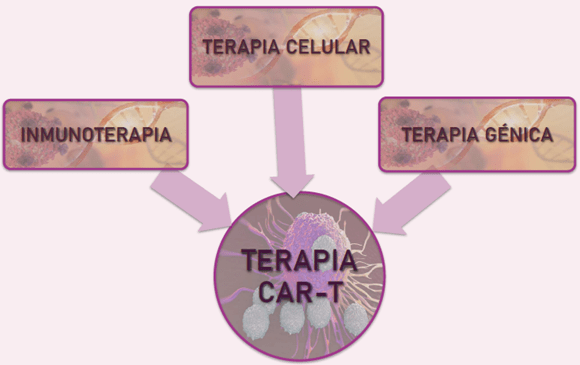
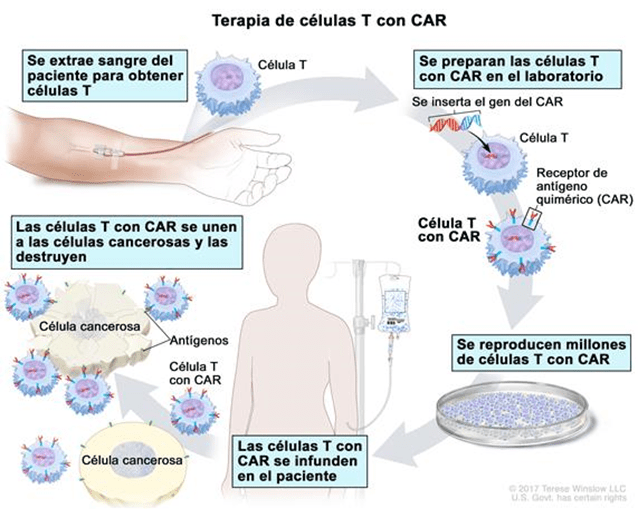
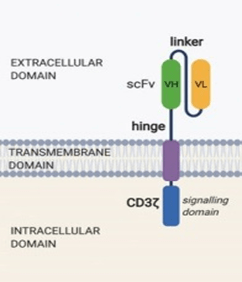
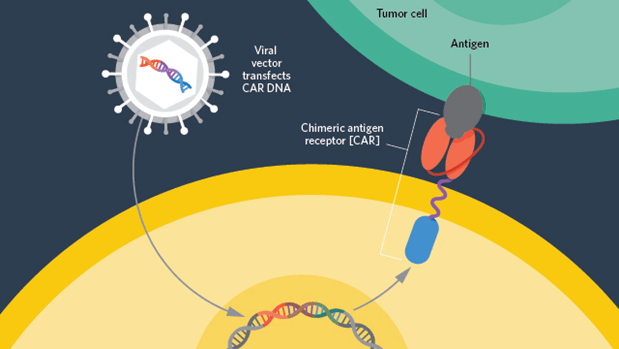
II Encuentro De Jóvenes Investigadores en Cáncer (EJIC) 2023 // II Young Cancer Researchers Meeting 2023
[ES]
El pasado mes de Junio durante los días 8, 9 y 10 tuvo lugar el II Encuentro de Jóvenes Investigadores en Cáncer (EJIC) 2023 en la ciudad de Calatayud (Zaragoza).
El encuentro fue un evento extraordinario en todos los sentidos, desde los estudiantes predoctorales seleccionados hasta las actividades realizadas en el mismo.
Desde la organización del EJIC hemos comprobado que, sin duda, ha sido una experiencia muy exitosa y enriquecedora para todos los EJICkers. El EJIC ha permitido crear un vínculo fuerte entre los estudiantes de doctorado provenientes de casi todo el territorio español, formando una gran piña entre todos ellos. Estas jornadas les han brindado la oportunidad de aprender, conocerse, compartir experiencias y disfrutar ¡El ambiente fue formidable!

En cuanto a las actividades y talleres que se planificaron en el encuentro, se realizaron con el objetivo principal de aprender, debatir y compartir las propias experiencias de los EJICkers y ponentes. El programa incluía diversas actividades, desde talleres de formación impartidos por investigadores postdoctorales hasta jefes de grupo. Por un lado, los postdocs Mikel García y Sara Labiano nos introdujeron como realizar presentaciones en congresos y explicaron el perfil investigador. Por otro lado, los postdocs Sergio Pedraza y Natalia Yanguas impartieron un taller de comunicación y publicación de resultados científicos.
Asimismo, se realizó un taller de estrategias y habilidades para la divulgación científica impartido por Sofía Hernández, divulgadora de la AECC. Del mismo modo, se impartió un taller de salud mental durante el doctorado, a cargo de las psicólogas de la AECC, Mercedes Márquez y Nieves Rubio.
A lo largo del EJIC también dimos la oportunidad de participar en el evento a los propios EJICkers, en los talleres del EJIC Thesis Contest y el EJIC Journal Club. Durante estas actividades los estudiantes nos explicaron con detalle sobre qué trataban sus investigaciones. Además, en el evento también se realizaron mesas redondas y de debate de algunos de los temas más relevantes para los estudiantes.
Al mismo tiempo, durante estas jornadas tuvimos el enorme placer de tener entre nosotros a tres investigadoras principales que nos contaron de forma muy cercana toda su trayectoria laboral, Verónica Torrano, Patricia Sancho y María Muñoz.

Por otro lado, tengo que dar las gracias a mi compañero Eduardo Ruiz, ya que ha sido imprescindible en la organización del evento. Sin duda, hemos formado un gran equipazo y como organizadores, estamos muy orgullosos y podemos decir que el EJIC 2023 ha sido muy gratificante y todo un éxito. ¡Ya estamos esperando ansiosos el EJIC 2024!
Por último, agradecer enormemente al ayuntamiento de Calatayud, a todos los colaboradores de la zona, a la AECC Zaragoza y a todos los voluntarios de la AECC Calatayud, por hacérnoslo todo tan fácil. ¡¡Habéis hecho que el EJIC 2023 fuera un éxito!!

[EN]
Last June during the 8th, 9th and 10th took place the II Young Cancer Researchers Meeting (in spanish, EJIC) 2023 in Calatayud (Zaragoza).
The meeting was an extraordinary event in all senses, from the selected predoctoral students to the activities carried out.
From the EJIC organization we have proved that, with no doubt, it has been a very successful and enriching experience for all the EJICkers. The EJIC has allowed us to create a strong bond between PhD students from almost all over Spain, forming a great team among all of them. These days have given them the opportunity to learn, get to know each other, share experiences and enjoy themselves. The atmosphere was amazing!

The activities planned for the meeting were carried out with the main objective of learning, debating and sharing the experiences of the EJICkers and speakers. The program included a variety of activities, from training workshops given by postdoctoral researchers to group leaders. On the one hand, postdocs Mikel Garcia and Sara Labiano introduced how to make presentations at conferences and explained the researcher profile. On the other hand, postdocs Sergio Pedraza and Natalia Yanguas gave a workshop on communication and publication of scientific results.
Likewise, a workshop on strategies and skills for scientific dissemination was given by Sofía Hernández, AECC disseminator . Similarly, a workshop on mental health during the PhD was given by AECC psychologists Mercedes Márquez and Nieves Rubio.
Along the EJIC we also gave the opportunity to participate in the event to the EJICkers themselves, in the EJIC Thesis Contest and the EJIC Journal Club. During these activities the students explained in detail what their research was about. In addition, the event also included round table discussions and debates on some of the most relevant topics for the students.
At the same time, during this conference we had the great pleasure of having among us three principal investigators who told us about their work career, Verónica Torrano, Patricia Sancho and María Muñoz.

On the other hand, I have to thank my colleague Eduardo Ruiz, since he has been essential in the organization of the event. No doubt, we have formed a great team and as organizers, we are very proud and we can say that the EJIC 2023 has been very rewarding and a success. We are already looking forward to the EJIC 2024!
Finally, a great thank you to the Calatayud City Council, to all the area collaborators, to Zaragoza AECC and to all the volunteers of Calatayud AECC, for making everything so easy for us. You have made EJIC 2023 a success!!